Понятие о степенях свободы в молекулярной физике. Число степеней свободы. Распределение энергии по степеням свободы молекул. Среднее число столкновений и средняя свободного пробега молекул
ФИЗИЧЕСКИЕ ОСНОВЫ ТЕРМОДИНАМИКИ
1. Первое начало термодинамики
§1. Внутренняя энергия
Всякая термодинамическая система в любом состоянии обладает энергией, которая называется полной энергией. Полная энергия системы складывается из кинетической энергии движения системы как целого, потенциальной энергии системы как целого и внутренней энергии.
 Внутренняя энергия системы представляет сумму всех видов хаотического (теплового) движения молекул: потенциальную энергию из внутриатомных и внутриядерных движений. Внутренняя энергия является функцией состояния газа. Для данного состояния газа внутренняя энергия определяется однозначно, то есть является определенной функцией.
Внутренняя энергия системы представляет сумму всех видов хаотического (теплового) движения молекул: потенциальную энергию из внутриатомных и внутриядерных движений. Внутренняя энергия является функцией состояния газа. Для данного состояния газа внутренняя энергия определяется однозначно, то есть является определенной функцией.
При переходе из одного состояния в другое внутренняя энергия системы изменяется. Но при этом внутренняя энергия в новом состоянии не зависти от процесса, по которому система перешла в данное состояние.
§2. Теплота и работа
Возможны два различных способа изменения внутренней энергии термодинамической системы. Внутренняя энергия системы может изменяться в результате выполнения работы и в результате передачи системе тепла. Работа есть мера изменения механической энергии системы. При выполнении работы имеет место перемещения системы или отдельных макроскопических частей относительно друг друга. Например, вдвигая поршень в цилиндр, в котором находиться газ, мы сжимаем газ, в результате чего его температура повышается, т.е. изменяется внутренняя энергия газа.
Внутренняя энергия может изменяться и в результате теплообмена, т.е. сообщения газу некоторого количества теплоты Q .
Отличие между теплотой и работой состоит в том, что теплота передаётся в результате целого ряда микроскопических процессов, при которых кинетическая энергия молекул более нагретого тела при столкновениях передаётся молекулам менее нагретого тела.
Общее между теплотой и работой, что они являются функциями процесса, т. е. можно говорить о величине теплоты и роботы, когда происходит переход системы из состояния первого в состояние второе. Теплота и робота не является функцией состояния, в отличие от внутренней энергии. Нельзя говорить, чему равна работа и теплота газа в состоянии 1, но о внутренней энергии в состоянии 1 говорить можно.
§3 I начало термодинамики
Допустим, что некоторая система (газ, заключённый в цилиндре под поршнем), обладая внутренней энергией, получила некоторое количество теплоты
Q
, перейдя в новое состояние, характеризуемой внутренней энергии
U
2
,
совершила работу А
над внешней средой, т. е. против внешних сил. Количество теплоты считается положительным, когда оно подводится к системе, и отрицательным, когда забирается у системы. Работа положительна, когда она совершается газом против внешних сил, и отрицательна, когда она совершается над газом.

I начало термодинамики : Количество тепла (Δ Q ), сообщённой системе идёт на увеличение внутренней энергии системы и на совершение системой работы (А) против внешних сил.
Запись I начало термодинамики в дифференциальной форме
dU - бесконечно малое изменение внутренней энергии системы
Элементарная работа, - бесконечное малое количество теплоты.
Если система периодически возвращается в первоначальное состояние, то изменение ее внутренней энергии равно нуля. Тогда
т. е. вечный двигатель I рода, периодически действующий двигатель, который совершал бы большую работу, чем сообщённая ему извне энергия, невозможен (одна их формулировок I начало термодинамики).
§2 Число степеней свободы молекулы. Закон о равномерном
распределении энергии по степеням свободы молекулы
Число степеней свободы : механической системы называется количество независимых величин, е помощью которых может быть задано положение системы. Одноатомный газ имеет три поступательные степени свободы і = 3 , так как для описания положения такого газа в пространстве достаточно трёх координат (х, у, z ).
Жесткой связью называется связь, при которой расстояние между атомами не изменяется. Двухатомные молекулы с жесткой связью (N 2 , O 2 , Н 2 ) имеют 3 поступательные степени свободы и 2 вращательные степени свободы: i = i пост + i вр =3 + 2=5.
Поступательные степени свободы связаны с движением молекулы как целого в пространстве, вращательные - с поворотом молекулы как целого. Вращение относительного осей координат x и z на угол приведет к изменению положения молекул в пространстве, при вращении относительно оси у молекула не изменяет своё положение, следовательно, координата φ y в данном случае не нужна. Трехатомная молекула с жёсткой связью обладает 6 степенями свободы
i = i пост + i вр =3 + 3=6
Если связь между атомами не жесткая, то добавляются колебательные с тепени свободы. Для нелинейной молекулы і кол . = 3 N - 6 , где N - число атомов в молекуле.
Независимо от общего числа степеней свободы молекул 3 степени свободы всегда поступательные. Ни одна из поступательных степеней не имеет преимущества перед другими, поэтому на каждую из них приходится в среднем одинаковая энергия, равна 1/3 значения
![]()
Больцман установил закон, согласно которому для статистической системы (т. е. для системы у которой число молекул велико), находящейся в состоянии термодинамического равновесия на каждую поступательную и вращательную степень свободы приходится в среднем кинематическая энергия, равная 1/2 kT , и на каждую колебательную степень свободы - в среднем энергия, равная kT . Колебательная степень свободы «обладает» вдвое большей энергией потому, что на нее приходится не только кинетическая энергия (как в случае поступательного и вращательного движения), но и потенциальная энергия, причем таким образом средняя энергия молекулы
До сих пор мы пользовались представлением о молекулах как об очень маленьких упругих шариках, средняя кинетическая энергия которых полагалась равной средней кинетической энергии поступательного движения (см. формулу 6.7). Такое представление о молекуле справедливо только для одноатомных газов. В случае многоатомных газов вклад в кинетическую энергию вносит еще и вращательное, а при высокой температуре – колебательное движение молекул.
Для того, чтобы оценить, какая доля энергии молекулы приходится на каждое из этих движений, введем понятие степеней свободы . Под числом степеней свободы тела (в данном случае молекулы) понимают число независимых координат , полностью определяющих положение тела в пространстве. Число степеней свободы молекулы обозначим буквойi.
Если молекула одноатомная (инертные газы Не, Ne,Arи др), то молекулу можно рассматривать как материальную точку. Так как положение материальной определяется тремя координатами х, у,z(рис.6.2, а), то одноатомная молекула обладает тремя степенями свободы поступательного движения (i= 3).

Молекулу двухатомного газа (Н 2 ,N 2 , О 2) можно представить как совокупность двух жестко связанных материальных точек – атомов (рис.6.2, б). Для определения положения двухатомной молекулы линейных координат х, у,zнедостаточно, так как молекула может вращаться вокруг центра координат. Очевидно, что такая молекула обладает пятью степенями свободы (i=5): - тремя – поступательного движения и двумя – вращения вокруг осей координат (из трех углов 1 , 2 , 3 независимы только два).
Если молекула состоит из трех и более атомов, не лежащих на одной прямой (СО 2 ,NH 3), то она, (рис.6.2, в) имеет шесть степеней свободы (i= 6): три – поступательного движения и три – вращения вокруг осей координат.
Выше было показано (см. формулу 6.7), что
средняя кинетическая энергия
 поступательного движения молекулы
идеального газа, принимаемой заматериальную
точку
, равна 3/2kТ.
Тогда на одну степень свободы
поступательного движения приходится
энергия, равная 1/2kТ. Этот
вывод в статистической физике обобщается
в виде закона Больцмана о равномерном
распределении энергии молекул по
степеням свободы: статистически в
среднем на любую степень свободы молекул
приходится одинаковая энергия, ε i ,
равная:
поступательного движения молекулы
идеального газа, принимаемой заматериальную
точку
, равна 3/2kТ.
Тогда на одну степень свободы
поступательного движения приходится
энергия, равная 1/2kТ. Этот
вывод в статистической физике обобщается
в виде закона Больцмана о равномерном
распределении энергии молекул по
степеням свободы: статистически в
среднем на любую степень свободы молекул
приходится одинаковая энергия, ε i ,
равная:
Таким образом, полная средняя кинетическая энергия молекулы
 (6.12)
(6.12)
Реально молекулы могут совершать еще и колебательные движения, причем на колебательную степень свободы приходится в среднем энергия в два раза большая, чем на поступательную или вращательную, т.е. kТ. Кроме того, рассматривая модель идеального газа, мы по определению не учитывали потенциальную энергию взаимодействия молекул.
Среднее число столкновений и средняя свободного пробега молекул
Процесс столкновения молекул удобно характеризовать величиной эффективного диаметра молекул d, под которым понимается минимальное расстояние, на которое могут сблизиться центры двух молекул.
Среднее расстояние, которое проходит
молекула между двумя последовательными
столкновениями, называется средней
длиной свободного пробега
молекулы .
.
Вследствие хаотичности теплового
движения траектория молекулы представляет
собой ломаную линию, точки изломов
которой соответствуют точкам столкновений
ее с другими молекулами (рис.6.3). За одну
секунду молекула проходит путь, равный
средней арифметической скорости
 .
Если
.
Если -
среднее число столкновений за 1 секунду,
то средняя длина свободного пробега
молекулы между двумя последовательными
соударениями
-
среднее число столкновений за 1 секунду,
то средняя длина свободного пробега
молекулы между двумя последовательными
соударениями
 =
= /
/ (6.13)
(6.13)
Для определения
 молекулу представим шариком с диаметромd(другие молекулы будем
считать неподвижными). Длина пути,
пройденного молекулой за 1 с, будет равна
молекулу представим шариком с диаметромd(другие молекулы будем
считать неподвижными). Длина пути,
пройденного молекулой за 1 с, будет равна .
Молекула на этом пути столкнется только
с теми молекулами, центры которых лежат
внутри ломанного цилиндра радиусомd(рис.6.3). Это молекулы А, В, С.
.
Молекула на этом пути столкнется только
с теми молекулами, центры которых лежат
внутри ломанного цилиндра радиусомd(рис.6.3). Это молекулы А, В, С.

Среднее число столкновений за 1 с будет равно числу молекул в этом цилиндре:
 =n 0 V,
=n 0 V,
где n 0 – концентрация молекул;
V– объем цилиндра, равен:
V =
πd 2 
Таким образом, среднее число столкновений
 =
n 0
π
=
n 0
π d 2
d 2
При учете движения других молекул более точно
 =
=
 πd 2 n 0
πd 2 n 0  (6.14)
(6.14)
Тогда средняя длина свободного пробега согласно (6.13) равна:
 (6.15)
(6.15)
Таким образом, длина свободного пробега
зависит только от эффективного диаметра
молекулы dи их концентрацииn 0 . Для примера оценим и
и .
Пустьd~10 -10 м,
.
Пустьd~10 -10 м, ~500
м/с,n 0 = 3·10 25 м -3 , то
~500
м/с,n 0 = 3·10 25 м -3 , то 3·10 9 с –1 и
3·10 9 с –1 и 7 ·10 - 8 м при давлении ~10 5 Па.
При уменьшении давления (см. формулу
6.8)
7 ·10 - 8 м при давлении ~10 5 Па.
При уменьшении давления (см. формулу
6.8) возрастает и достигает величины в
несколько десятков метров.
возрастает и достигает величины в
несколько десятков метров.
Чтобы разобраться в связи температуры с внутренней энергией, повторим введенное ранее в механике понятие - число степеней свободы .
В § 1.3 было показано, что давление газа численно равно импульсу , который передается за единицу времени единице площади стенки в результате ударов по ней молекул, поэтому давление определяется средней энергией только поступательного движения молекул.
Поступательное движение любой системы «как целого» полностью определяется движением одной единственной точки: её центра масс. В частности, полный импульс любой нерелятивистской системы, равен произведению массы этой системы на скорость движения её центра масс. Энергия поступательного движения системы «как целого» равна ![]() . Поэтому, для полного описания поступательного движения любой системы в трехмерном
пространстве необходимо и достаточно задание значений трех
координат центра масс. Таким образом, поступательному движению, как бы ни была устроена система, всегда соответствуют три поступательных степени свободы: .
. Поэтому, для полного описания поступательного движения любой системы в трехмерном
пространстве необходимо и достаточно задание значений трех
координат центра масс. Таким образом, поступательному движению, как бы ни была устроена система, всегда соответствуют три поступательных степени свободы: .
Можно сказать и так: «с точки зрения поступательного движения» любая система может быть точно, а не приближенно, представлена в виде одной единственной материальной точки совпадающей с центром масс системы и имеющей массу равную массе системы (рис. 1.15).

Рис. 1.15. Одноатомная молекула
Если же говорить о полной внутренней энергии газа U, то она складывается, вообще говоря, из многих компонентов, соответствующих всем возможным видам движения в молекуле и энергии взаимодействия молекул между собой. При рассмотрении идеального газа, энергией взаимодействия молекул пренебрегают.
Рассмотрим для начала благородный газ, например, гелий . Дело в том, что все благородные газы одноатомны, из них гелий самый легкий и, соответственно, самого простого устройства. Атом гелия (имеется в виду основной изотоп ) - это положительно заряженное ядро из 2 протонов и 2 нейтронов и электронная оболочка из 2 отрицательно заряженных электронов. Итого 6 частиц, если каждую из них считать материальной точкой, то это 18 степеней свободы. Но, не все так удручающе мрачно, выручает квантовая механика. Не вдаваясь в «квантовые» подробности, укажем, что для изменения состояния электронной оболочки атома гелия, а именно: для перевода её из основного состояния с минимально возможной энергией в имеющее большую энергию возбужденное состояние необходима минимальная энергия около 20 эВ. Более точно, например, при возбуждении электронной оболочки атома гелия возможен переход, требующий 19,8198 эВ. Энергетический спектр атомов дискретен: принять меньшую энергию атом гелия просто не может , он так устроен. При столкновении атома гелия с электроном меньшей энергии, атом гелия останется в исходном - основном состоянии с наименьшей возможной внутренней энергией, величина которой зависит только от выбора начала отсчета энергии, и, чаще всего, принимается просто равной нулю. Такое столкновение будет абсолютно упругим. Отметим, что
Поэтому энергии в 20 эВ соответствует температура порядка кельвинов. Наверное нетрудно сообразить, что даже при температуре в К атомов гелия движущихся столь быстро, что энергия их относительного движения в 100 раз больше её среднего значения, будет ничтожно мало. Но, тогда столкновения, сопровождающиеся изменением внутренней энергии одного из сталкивающихся атомов, будут чрезвычайно редки, следовательно, возможным наличием атомов с возбужденной электронной оболочкой можно пренебречь и приближенно считать, что все атомы имеют электронную оболочку в одном и том же основном состоянии с минимально возможной энергией. Не так важно, что электронные оболочки всех атомов имеют минимально возможную энергию, как важно, что она одна и та же у всех атомов и не меняется даже при сильном нагреве газа. Тогда, суммарная энергия электронных оболочек всех атомов есть просто константа равна , где N - число атомов в газе, а - энергия электронной оболочки каждого из атомов. При фиксированном полном числе атомов эта величина ни от каких параметров состояния газа не зависит . Остается ещё раз вспомнить, что энергия всегда определена с точностью до аддитивной постоянной и выбросить эту константу, изменив начало отсчета энергии.
Для изменения состояния ядер атомов необходима энергия в сотни тысяч эВ, что «по газовым масштабам» чудовищно много. Соответствующие температуры наблюдаются лишь во внутренних областях Звёзд. Поэтому о возможности изменения внутреннего состояния ядер в процессе столкновений в газе говорить не приходится (имеются ввиду стабильные ядра, возможный распад нестабильных ядер не имеет отношения к параметрам состояния газа).
Что же остается? Остается поступательное движение атома как целого, то есть три поступательных степени свободы. Это оправдывает использование такой модели:
На всякий случай оговоримся, что в данный момент нас не интересуют процессы установления в газе термодинамического равновесия. Равновесие устанавливается именно в результате взаимодействия частиц газа при их столкновениях, поэтому модель «атом - материальная точка» такие процессы не описывает.
Положение с электронной оболочкой не меняется, если атомы входят в состав многоатомной молекулы. Минимальная энергия, необходимая для изменения состояния (возбуждения) электронной оболочки молекул примерно та же, что и для возбуждения электронных оболочек атомов. Характерная для атомно-молекулярного мира цифра составляет порядка 10 эВ, чему соответствует температура порядка сотни тысяч кельвинов. При таких температурах газ уже не газ, а низкотемпературная плазма. Поэтому, пока газ остается газом, в подавляющем большинстве случаев, можно с великолепной точностью считать, что электронные оболочки всех молекул газа находятся в одном и том же состоянии, их суммарная энергия есть не зависящая от параметров состояния газа константа , которую можно опустить. Конечно есть исключения, требующие известной осторожности. Например, у молекулы кислорода есть - по атомно-молекулярным меркам - весьма долгоживущее возбужденное состояние, для перевода в которое этой молекуле требуется всего 0,982 эВ. Именно в этом состоянии молекула кислорода чрезвычайно активна химически, это весьма важное и интересное своими последствиями исключение, но исключение, которое совершенно необходимо учитывать в соответствующих задачах, например, при расчетах скоростей химических реакций с участием этой молекулы.
Таким образом, и в составе молекулы, атом можно рассматривать как материальную точку.
Отдельно остановимся на подсчете числа вращательных и колебательных степеней свободы многоатомных молекул. Начнем с рассмотрения вращательных степеней свободы двухатомной молекулы. Все двухатомные молекулы линейны по той простой причине, что две несовпадающих точки определяют прямую, другими словами, две точки всегда лежат на одной прямой (рис. 1.16). Есть и более сложные, но линейные молекулы, например, молекула углекислого газа линейна: в основном (с наименьшей возможной энергией) состоянии все три её атома лежат на одной прямой.

Рис. 1.16. Двухатомная молекула
Обычно, при расчете внутренней энергии газа, учитывается вращение линейной молекулы только вокруг двух её главных осей, проходящих через центр масс и перпендикулярных оси молекулы, вращение молекулы вокруг её оси симметрии не рассматривается, что совершенно правильно. Но на этом основании заявляется, что у линейной молекулы только 2 вращательных степени свободы, что категорически неправильно. Впрочем, дальше и мы будем так писать, что, разумеется, требует объяснений. То, что вращательных степеней свободы только две, очевидным образом неправильно по следующей причине. Линейная молекула это пространственное образование, имеющее конечные размеры во всех трех измерениях. Например, расстояние между ядрами в молекуле составляет метра, а газокинетический радиус (радиус в модели: молекула - шарик) равен метра. Радиусы ядер азота порядка метра. Учитывая, что , возникает законный вопрос: «Почему бы ей не вертеться и вокруг собственной оси?» Опять "виновата" квантовая механика. Квантовомеханический расчет показывает, что энергия, необходимая для того чтобы возбудить вращение вокруг некоторой оси, обратно пропорциональна моменту инерции относительно этой оси. Поэтому, о возбуждении вращения ядер речь не идет - слишком мал радиус этих «шариков», соответственно, слишком велика минимальная энергия необходимая для приведения их во вращательное движение. Это опять сотни килоэлектронвольт: так называемые, вращательные уровни энергии ядер. Остается одно: «завертеть» вокруг оси молекулы её электронную оболочку, но всякое изменение состояния электронной оболочки требует энергии порядка 10 эВ. Конкретно, чтобы «завертеть» молекулу вокруг её оси, то есть перевести молекулу в первое вращательно-возбужденное состояние, требуется 7,35 эВ, чему соответствует температура, превышающая семьдесят тысяч градусов. Таким образом, при «газовых» температурах, то есть при тех температурах, когда газ ещё газ, а не плазма (меньших нескольких тысяч градусов) число линейных молекул вращающихся вокруг собственной оси будет пренебрежимо мало.

Рис. 1.17. Линейная молекула
Общая ситуация такова. Кажущееся отсутствие у молекулы некоторых степеней свободы есть следствие того, что энергия, необходимая для возбуждения соответствующих видов движения, в силу квантовых причин , слишком велика (а не мала!, рис. 1.17). Молекул, в которых эти виды движения возбуждены в результате столкновений молекул между собой, либо нет вовсе (в разумных количествах газа), либо они есть, но в настолько малом относительном количестве, что вклад во внутреннюю энергию газа этих видов движения пренебрежимо мал. Это касается всех тех степеней свободы, которые связаны с электронами электронной оболочки молекулы. Именно по этой причине и изолированный атом и атом в молекуле можно рассматривать как материальную точку (рис. 1.18).

Рис. 1.18. Трехатомная молекула
В силу сказанного, определение числа степеней свободы молекулы в рамках модели: «атом - материальная точка», сводится к следующему.
Если молекула состоит из атомов - материальных точек, степеней свободы:
всего - , из них:
поступательных - 3 всегда,
вращательных - 3 (пространственная молекула) или 2 (линейная молекула),
колебательных - или для пространственной (линейной) молекул.
Настоятельно рекомендуем подсчитывать степени свободы именно в таком порядке: всего, поступательных, вращательных, что осталось – колебательные. Не следует ориентироваться на структурные химические формулы, на них показаны химические связи, а не возможности тех или иных колебательных движений групп ядер или отдельных ядер входящих в состав молекулы атомов. Например, никак не отражается возможность крутильных колебаний. Использование этих формул чаще всего приводит к ошибкам при подсчете числа колебательных степеней свободы. О структуре молекулы необходимо знать только одно: линейная она или нет.
Приведем три примера подсчета числа степеней свободы для молекул ![]() . Предварительно введем «число классическое», которое обозначим так , оно потребуется в дальнейшем:
. Предварительно введем «число классическое», которое обозначим так , оно потребуется в дальнейшем:
здесь число поступательных степеней свободы, число вращательных степеней свободы и число колебательных степеней свободы. Из-за двойки перед это число вовсе не равно полному числу степеней свободы молекулы и не должно так называться.
Таблица 1.4.1.
|
Молекула / Степеней свободы; |
линейная |
линейная |
плоская или пространственная |
|
|
Поступательных |
||||
|
Вращательных |
||||
|
Колебательных |
||||
Молекула этана имеет две равновесные конфигурации: в одном случае все восемь атомов лежат в одной плоскости, в другой равновесной конфигурации плоскости, в которых лежат «левая» четверка и «правая» четверка , взаимно перпендикулярны. В обеих равновесных конфигурациях возможны крутильные колебания этих плоскостей с атомами около своих положений равновесия. Колебания атомов, а точнее ядер атомов, входящих в состав многоатомной молекулы, суть внутреннее движение в молекуле, поэтому удобнее всего рассматривать это движение в системе центра масс молекулы.
Чтобы понять, почему у трехатомной молекулы воды три колебательных степени свободы, а у также трехатомной молекулы углекислого газа их четыре, рассмотрим собственные моды колебаний ядер в молекуле .
Четыре моды колебаний этой молекулы представляют собой следующее. Симметричная мода : все три ядра остаются на одной прямой, ядро углерода неподвижно, два ядра кислорода колеблются в противофазе, то есть половину периода они сближаются друг с другом и с ядром углерода, двигаясь к нему с двух противоположных сторон; другую половину периода они, по-прежнему в противофазе, удаляются друг от друга и от ядра углерода. Асимметричная мода : все три ядра остаются на одной прямой, два ядра кислорода, как единое целое (при неизменном расстоянии между ними) колеблются в противофазе с ядром углерода. Двукратно вырожденная деформационная мода : ядра не остаются на одной прямой; в тот момент, когда они покидают положения равновесия, находящиеся на прямой , они (все три) движутся в направлениях перпендикулярных к этой прямой. Если, условно говоря, ось молекулы горизонтальна и ядро углерода движется вверх, то оба ядра кислорода движутся при этом вниз. То есть, два ядра кислорода колеблются синфазно между собой и в противофазе с ядром углерода. Это понятно: иначе центр масс молекулы не будет оставаться неподвижным.
Две строго равные собственные частоты двукратно вырожденной деформационной моды соответствуют движению ядер в двух взаимно перпендикулярных плоскостях. Если возбуждены колебания только одной из двух деформационных мод, то все три ядра остаются в фиксированной в пространстве плоскости. Если возбуждены колебания в обеих взаимно перпендикулярных плоскостях (обе моды), то траектории всех трех ядер, как результат сложения двух взаимно перпендикулярных колебаний со строго равными астотами, есть эллипсы, а при равных амплитудах и сдвиге по фазе - окружности. При этом, если ядро углерода движется по своему эллипсу « по» часовой стрелке, то оба ядра кислорода движутся по своим одинаковым эллипсам « против часовой стрелки». Слова « по» и « против» взяты в кавычки по очевидной причине: они условны, так как зависят от того, с какой стороны смотреть.
Таким образом, четырем колебательным степеням свободы молекулы соответствуют только три разных частоты, так как деформационная мода двукратно вырождена.
У любой двухатомной молекулы в рамках модели «атом - материальная точка» есть одна колебательная степень свободы, которой соответствует весьма простое движение: осциллирует расстояние между двумя её ядрами. Однако, нередко, макроскопические характеристики двухатомного газа, например, его теплоемкости при постоянном объеме и давлении , их отношение - показатель адиабаты и другие, имеют (с процентной точностью!) такие значения, как если бы у этих молекул колебательной степени свободы не было. Подчеркнем, что этот «казус» имеет место, во-первых, не для всех молекул и, во-вторых, лишь при не слишком больших температурах, не превышающих нескольких сотен кельвинов. Такая ситуация имеет место, например, для воздуха (грубо 80 % азота и 20 % кислорода ) при комнатных температурах ![]() . Совершенно очевидно, что число степеней свободы молекулы не может зависеть от параметров состояния газа, в состав которого она входит. Это число определяется трехмерностью пространства и моделью: «атом - материальная точка». Спрашивается: «В чем дело?».
. Совершенно очевидно, что число степеней свободы молекулы не может зависеть от параметров состояния газа, в состав которого она входит. Это число определяется трехмерностью пространства и моделью: «атом - материальная точка». Спрашивается: «В чем дело?».
Для возбуждения колебаний ядер в молекуле азота ей необходимо сообщить энергию не меньшую, чем , у молекулы кислорода, как говорят в таких случаях, «колебательный квант» немного меньше, а именно: . Предваряя сам квантовомеханический расчет, сообщим его результаты.
При комнатной температуре ![]() доля колебательно-возбужденных молекул азота от их общего числа составит примерно
доля колебательно-возбужденных молекул азота от их общего числа составит примерно 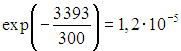 , для кислорода эта доля примерно равна
, для кислорода эта доля примерно равна  . Таким образом, в каждом кубическом сантиметре воздуха при комнатной температуре будет более колебательно-возбужденных молекул азота и порядка колебательно-возбужденных молекул кислорода. Вряд ли в этих условиях можно говорить о том, что эти молекулы «жесткие» и у них только пять степеней свободы, так как колебательной степени свободы у них нет. Тем более, что уже при температуре в 1000 К доли колебательно-возбужденных молекул составят для азота около 3 % и около 10 % для кислорода. В качестве ещё одного примера приведем молекулу , для возбуждения колебаний ядер в которой требуется минимальная энергия всего . Уже при комнатной температуре доля колебательно-возбужденных молекул составит примерно 20 %. Пренебрегать колебаниями ядер в этой молекуле нельзя уже при комнатной температуре.
. Таким образом, в каждом кубическом сантиметре воздуха при комнатной температуре будет более колебательно-возбужденных молекул азота и порядка колебательно-возбужденных молекул кислорода. Вряд ли в этих условиях можно говорить о том, что эти молекулы «жесткие» и у них только пять степеней свободы, так как колебательной степени свободы у них нет. Тем более, что уже при температуре в 1000 К доли колебательно-возбужденных молекул составят для азота около 3 % и около 10 % для кислорода. В качестве ещё одного примера приведем молекулу , для возбуждения колебаний ядер в которой требуется минимальная энергия всего . Уже при комнатной температуре доля колебательно-возбужденных молекул составит примерно 20 %. Пренебрегать колебаниями ядер в этой молекуле нельзя уже при комнатной температуре.
Вряд ли разумно говорить, что наличие или отсутствие колебательной степени свободы у двухатомной молекулы зависит от типа молекулы и температуры газа. Это попытка «запихнуть» носящее квантовый характер колебательное движение ядер в рамки неадекватного в данном случае классического (не квантового) описания. Колебательная степень свободы у двухатомной молекулы есть всегда, а вот вклад колебательного движения ядер в такой молекуле во внутреннюю энергию газа, в теплоемкости и , в показатель адиабаты и другие характеристики газа может быть пренебрежимо мал, если выполняется неравенство
![]()
где введенная выше постоянная Больцмана. При выполнении противоположного неравенства
пренебрегать колебательным движением ядер никак нельзя. Классическое (не квантовое) описание колебательного движения ядер в молекулах возможно лишь в случае малой энергии возбуждения колебательного движения и достаточно высокой температуры, а именно: при выполнении неравенства
![]() ,
,
которое на практике выполняется лишь в редких исключительных случаях вроде молекулы . В том воздухе, которым мы можем относительно комфортно дышать, колебания ядер в молекулах и классической механикой не описываются.
Вернемся теперь к идеальному газу. Мы видели, что средняя кинетическая энергия поступательного движения молекул равна
![]()
и что поступательному движению соответствуют три степени свободы. Значит, на одну степень свободы, в состоянии термодинамического равновесия приходится средняя энергия
При классическом (не квантовом) описании все виды движения равноправны. Молекулы сталкиваются, и при этом легко может случиться так, что энергия поступательного движения перейдет в энергию вращательного движения. Поэтому на каждую из вращательных степеней свободы должно приходиться в среднем то же количество энергии -
Это утверждение известно как закон Больцмана о равнораспределении энергии по степеням свободы. Похожим образом столкновения молекул могут породить и колебательные движения ядер в них, так что классический закон равнораспределения относится также и к колебательным степеням свободы молекул. Но здесь есть одна тонкость. Если поступательному и вращательному движениям соответствует только кинетическая энергия, то гармонический осциллятор (одна колебательная степень свободы) обладает в среднем строго равными кинетической и потенциальной энергиями. Поэтому, в среднем, в состоянии термодинамического равновесия, в условиях применимости классического описания колебательного движения , на одну колебательную степень свободы приходится энергия в два раза большаяуже вовсе не есть номинальное число колебательных степеней многоатомной молекулы, то средняя энергия одной молекулы будет равна
мы познакомимся в следующей главе, где прояснится смысл этого термина. Как было показано выше, колебательное движение ядер в молекулах возбуждается лишь по достижении достаточно высоких температур (Т > 1000 К ), поэтому их вклад во внутреннюю энергию газа для большинства молекул при обычных (близких к комнатной) температурах ничтожен, мы не будем его учитывать, то есть, если не оговорено противное будем считать, что
![]() ,
,
где и равны номинальному числу поступательных (всегда 3) и вращательных (3 или 2) степеней свободы, соответственно структуре молекулы.
Пример. В комнате объемом 75 м 3 находится двухатомный газ (воздух) при температуре t = 12 °С (T = 285 К ). Включают обогреватель и поднимают температуру воздуха до t 2 = 22 °С (Т 2 = 295 К ). Поскольку комната не герметизирована, давление газа остается все время постоянным и равным 100 кПа . Найдем изменение внутренней энергии газа в комнате и определим, какая энергия была потрачена на обогрев окружающей среды.
Ответ несколько неожидан: согласно (1.19) внутренняя энергия газа в комнате не изменилась, поскольку остались прежними и его давление, и объем. С другой стороны, часть газа из комнаты вышла: если вначале там содержалось
Поскольку внутренняя энергия пропорциональна абсолютной температуре, после нагрева герметичной комнаты оказывается, что

то есть от печки получена энергия
На втором этапе мы удаляем из комнаты 3,39 % подогретого воздуха, и вместе с ним ту же долю энергии. Удаляемая энергия
в точности равна энергии, полученной от печки. Иным путем мы снова пришли к тому же выводу.
Итак, теперь окончательно ясно, что ушедший на улицу воздух унес с собой всю энергию, полученную от печки. В чем же тогда роль печки? Стоило ли ее вообще включать, если она обогревает только улицу? Полезный эффект печки состоит в том, что при температуре в 12 градусов теплопотери человека в окружающий воздух столь велики (несмотря на то, что он одет, надо полагать), что система терморегуляции организма справляется с трудом с поддержанием нормальной температуры и сигнализирует об этом: холодно человеку, некомфортно! А при температуре 22 градуса теплопотери существенно меньше, меньше нагрузка на систему терморегуляции - человек чувствует себя вполне комфортно и у него не возникает желания включать обогреватель.
Дополнительная информация
http://eqworld.ipmnet.ru/ru/library/physics/thermodynamics.htm - Я. де Бур Введение в молекулярную физику и термодинамику, Изд. ИЛ, 1962 г. - стр. 50–61, ч. I, § 6, - теоретический расчет теплоемкостей, приводятся экспериментальные зависимости теплоемкости при постоянном объеме в широком интервале температур для десяти конкретных газов.
Перейдем теперь к детальному рассмотрению понятия внутренней энергии идеального газа и связи этой энергии с количеством степеней свободы молекул. Ранее в модели идеального газа мы учитывали только энергию поступательного движения молекул. Такой подход хорошо описывает одноатомный газ. В соответствии с классической механикой, число степеней свободы одноатомной молекулы равно количеству координат, необходимому для задания их положения в пространстве. В нашем трехмерном пространстве число координат и число степеней свободы одноатомного газа равно трем. В соответствии с (9.6) средняя кинетическая энергия поступательного движения молекул, определяемая через средний квадрат скорости v? B , пропорциональна температуре газа
При этом из изотропии пространства (равноправности всех направлений) средние квадраты компонент скорости равны v* KB = Vy KB = = Vz KB , что позволяет сопоставить каждой из координат и каждой степени свободы треть средней кинетической энергии поступательного движения молекул. Таким образом, можно считать, что на каждую степень свободы приходится в среднем энергия
Если молекула газа не одноатомная, а состоит из N атомов, то для задания их положения в пространстве необходимо 3N координат. Таким образом, молекула из N атомов имеет 3N степеней свободы. Поскольку многоатомная молекула является единым целым, то удобно рассматривать движение ее центра масс с тремя поступательными степенями свободы. При этом оставшиеся степени свободы приходятся на вращательное и колебательное движения молекулы. Теоретическая механика утверждает, что нелинейная молекула, состоящая из трех и более атомов, способна участвовать в трех независимых вращательных движениях относительно трех осей координат. Любое другое вращение можно представить как их комбинацию. Поэтому число вращательных степеней свободы нелинейной молекулы равно трем. Для линейной молекулы из двух и более атомов (выстроенных вдоль одной линии) учет вращения вокруг оси, соединяющей атомы, считающиеся материальными точками, не дает вклада в энергию. Поэтому число вращательных степеней свободы линейной молекулы равно двум. Оставшиеся степени свободы приходятся на колебательное движение. Несложно посчитать, что число колебательных степеней свободы для нелинейной молекулы равно 3N-6, а для линейной молекулы - 3N-5.
В случае многоатомного газа (как и для одноатомного) действует закон о равномерном распределении энергии по степеням свободы: средняя кинетическая энергия, приходящаяся при тепловом равновесии на одну степень свободы молекулы, равна ~кТ.
Особо следует учитывать энергию колебательных степеней свободы. При нормальной и низкой температурах колебательное движение молекул обычно описывается законами квантовой механики. Эти законы обосновывают жесткость молекул и отсутствие колебательной энергии - в этом случае считают, что колебательные степени свободы выморожены (отсутствуют). При высоких же температурах на колебательную степень свободы помимо кинетической энергии - кТ приходится такая же потенциальная энергия, так что в сумме получается кТ. (Из модели гармонического осциллятора следует, что средняя потенциальная энергия колебательного движения равна средней кинетической энергии.)
Таким образом, в общем случае средняя внутренняя энергия молекулы равна
а внутренняя энергия моля идеального газа равна
где i - эффективное число степеней свободы молекулы.
Как следует из вышеприведенных рассуждений, для одноатомной молекулы /=3, для линейной молекулы при нормальной и низкой температурах /=5, для нелинейной молекулы при нормальной и низкой температурах /=6. При высоких температурах порядка 10 3 К для линейной молекулы i=6N-5, для нелинейной молекулы i= 6 N- 6 .
Отметим, что при очень низких температурах (порядка 10 К) вымораживаются и вращательные степени свободы. Это связано с тем, что законы классической статистической механики, на которых основан закон о равномерном распределении энергии по степеням свободы, перестают работать, и необходимо применение квантовомеханических законов.
Молекулы идеального газа не взаимодействуют друг с другом и, следовательно, не обладают потенциальной энергией. Поэтому вся энергия молекул идеального газа состоит только из кинетической энергии поступательного и вращательного движений. Среднюю кинетическую энергию поступательного движения молекулы мы определили в предыдущем параграфе [формула (17)]. Для учета средней кинетической энергии вращательного движения молекулы необходимо ввести в рассмотрение понятие числа степеней свободы тела.
Числом степеней свободы тела называется число независимых координат, определяющих положение тел в пространстве.
Поясним данное определение. Если тело перемещается в пространстве совершенно произвольно, то это перемещение всегда можно составить из шести одновременных независимых движений: трех поступательных (вдоль трех осей прямоугольной системы координат) и трех вращательных (вокруг трех взаимно перпендикулярных осей, проходящих через центр тяжести тела) (рис. 75). Иными словами, положение тела в пространстве определяется в этом случае шестью независимыми координатами: тремя линейными и тремя угловыми Следовательно, согласно определению, число степеней свободы произвольно движущегося в пространстве тела равно шести (три поступательных и три вращательных степени свободы). Если свобода движения тела ограничена, то его число степеней свободы меньше шести. Например, тело движется только по плоскости, имея при этом возможность произвольного вращения (катящийся мяч). Тогда число его степеней свободы равно пяти (две поступательных и три вращательных). Железнодорожный вагон имеет одну степень свободы (поступательную), так как он движется только по линии. Колесо вагона имеет две степени свободы: одну поступательную (вместе с гагоном) и одну вращательную (вокруг горизонтальной оси).
Вернемся теперь к вопросу о кинетической энергии молекулы газа. Ввиду полной хаотичности движения молекул все виды их движений (и поступательные, и вращательные) одинаково возможны (равновероятны). Поэтому на каждую степень свободы молекулы приходится в среднем одинаковое количество энергии (теорема Больцмана о равномерном распределении энергии по степеням свободы).
Поскольку молекулы движутся совершенно произвольно, они должны были бы иметь по шесть степеней свободы. Однако здесь надо принять во внимание следующее обстоятельство.
Молекулу одноатомного газа (например, Не) можно представить как материальную точку, вращение которой вокруг собственных осей не изменяет ее положения в пространстве. Значит, для определения положения одноатомной молекулы достаточно задать только ее линейные координаты. Поэтому одноатомной молекуле следует приписать число степеней свободы, равное трем (поступательным). С физической точки зрения это обстоятельство можно пояснить так. Кинетическая энергия вращательного движения тела (см. § 23) равна
![]()
где - угловая скорость вращения, I - момент инерции тела. Для материальной точки
где масса материальной точки, ее расстояние от оси вращения. Если материальная точка вращается вокруг своей оси, то Но тогда и Следовательно, у одноатомной молекулы на вращательнсе движение (на вращательные степени свободы) приходится бесконечно малая энергия, которой можно пренебречь. Строгое доказательство этого положения возможно только на основе квантовой механики.

Молекулу двухатомного газа (например, ) можно представить как совокупность двух материальных точек - атомов, жестко связанных между собой химическими связями (рис. 76, а). Вращение такой молекулы вокруг оси, проходящей через оба атома, не меняет положения молекулы в пространстве. С физической же точки зрения энергия, приходящаяся на вращение молекулы вокруг оси, проходящей через атомы, близка к нулю. Поэтому двухатомной молекуле следует приписать пять степеней свободы (три поступательных и две вращательных).
Что касается трехатомной молекулы (рис. 76, б), то она, очевидно, имеет все шесть степеней свободы (три поступательных и три вращательных). Столько же степеней свободы имеют и другие многоатомные молекулы (четырехатомные, пятиатомные и т. д.).
Для подсчета средней кинетической энергии, приходящейся на одну степень свободы молекулы, воспользуемся формулой (17):
Так как эта энергия получена для одноатомной молекулы (как материальной точки), имеющей три степени свободы, то на одну степень свободы молекулы приходится энергия
![]()
Тогда, согласно упомянутой теореме Больцмана, молекула, имеющая степеней свободы, будет обладать полной кинетической энергией
![]()
Следовательно, полная кинетическая энергия молекулы газа пропорциональна его абсолютной температуре и зависит только от нее.
Из формулы (19) вытекает физический смысл абсолютного нуля температуры: при будет и т. е. при абсолютном нуле прекращается движение молекул газа.
Согласно формуле (19), одноатомная молекула имеет полную энергию
![]()
двухатомная молекула имеет полную энергию
![]()
трехатомная и многоатомная молекулы имеют полную энергию
![]()
Тогда внутренняя энергия некоторой массы газа равна произведению числа молекул, содержащихся в этой массе, на полную кинетическую энергию одной молекулы:
![]()
Так как для моля газа то для внутренней энергии моля получим (учитывая, что






