Conceptul de grade de libertate în fizica moleculară. Numărul de grade de libertate. Distribuția energiei pe gradele de libertate ale moleculelor. Numărul mediu de ciocniri și calea liberă medie a moleculelor
BAZA FIZICĂ A TERMODINAMICĂ
1. Prima lege a termodinamicii
§1. Energie interna
Orice sistem termodinamic în orice stare are energie, care se numește energie totală. Energia totală a sistemului este formată din energia cinetică a mișcării sistemului ca întreg, energia potențială a sistemului ca întreg și energia internă.
 Energia internă a sistemului reprezintă suma tuturor tipurilor de mișcări haotice (termice) a moleculelor: energia potențială din mișcările intra-atomice și intranucleare. Energia internă este o funcție a stării gazului. Pentru această stare energia internă a gazului este determinată fără ambiguitate, adică este o funcție specifică.
Energia internă a sistemului reprezintă suma tuturor tipurilor de mișcări haotice (termice) a moleculelor: energia potențială din mișcările intra-atomice și intranucleare. Energia internă este o funcție a stării gazului. Pentru această stare energia internă a gazului este determinată fără ambiguitate, adică este o funcție specifică.
La trecerea de la o stare la alta, energia internă a sistemului se modifică. Dar, în același timp, energia internă într-o stare nouă nu depinde de procesul prin care sistemul a trecut în această stare.
§2. Caldura si munca
Există două moduri diferite de a modifica energia internă a unui sistem termodinamic. Energia internă a sistemului se poate modifica ca urmare a muncii efectuate și ca urmare a transferului de căldură către sistem. Munca este o măsură a schimbării energiei mecanice a sistemului. La efectuarea lucrărilor, sistemul sau părțile macroscopice individuale se deplasează unul față de celălalt. De exemplu, împingând un piston într-un cilindru în care există un gaz, comprimăm gazul, în urma căruia temperatura acestuia crește, adică. energia internă a gazului se modifică.
Energia internă se poate modifica și ca urmare a schimbului de căldură, de exemplu. dând puțină căldură gazuluiQ.
Diferența dintre căldură și muncă este că căldura este transferată ca urmare a unui număr de procese microscopice în care energia cinetică a moleculelor unui corp mai încălzit este transferată către moleculele unui corp mai puțin încălzit în timpul coliziunilor.
Lucrul comun dintre căldură și muncă este că sunt funcții ale procesului, adică putem vorbi despre cantitatea de căldură și roboți atunci când sistemul trece de la prima stare la a doua stare. Căldura și robotul nu sunt o funcție de stare, spre deosebire de energia internă. Este imposibil de spus cu ce este egală munca și căldura gazului în starea 1, dar putem vorbi despre energia internă în starea 1.
§3euînceputul termodinamicii
Să presupunem că un sistem (gaz prins în cilindrul de sub piston), care posedă energie internă, a primit o anumită cantitate de căldurăQtrecând într-o stare nouă caracterizată de energie internăU 2
,
a facut treaba A asupra mediului extern, adică împotriva forțelor externe. Cantitatea de căldură este considerată pozitivă atunci când este furnizată sistemului și negativă atunci când este preluată din sistem. Munca este pozitivă atunci când se face cu un gaz împotriva forțelor externe și negativă atunci când se face cu un gaz.
euînceputul termodinamicii : Cantitatea de căldură (Δ Q ), sistemul comunicat merge să crească energia internă a sistemului și să efectueze lucru (A) de către sistem împotriva forțelor externe.
Înregistrare euînceputul termodinamicii în formă diferenţială
dU- modificarea infinitezimală a energiei interne a sistemului
munca elementara,- o cantitate infinită de căldură.
Dacă sistemul revine periodic la starea inițială, atunci modificarea energiei sale interne este egală cu zero. Atunci
adică mașină cu mișcare perpetuăeuamabil, un motor care funcționează periodic și care ar lucra mai mult decât energia care i-a fost transmisă din exterior este imposibil (una dintre formulările loreuînceputul termodinamicii).
§2 Numărul de grade de libertate ale moleculei. Legea uniformă
distribuția energiei pe gradele de libertate ale moleculei
Numărul de grade de libertate: Un sistem mecanic este numărul de mărimi independente care pot fi utilizate pentru a seta poziția sistemului. Un gaz monoatomic are trei grade de libertate de translației = 3, deoarece trei coordonate (x, y, z).
Legătură rigidăse numește legătură în care distanța dintre atomi nu se modifică. Molecule diatomice cu o legătură rigidă (N 2 , O 2 , H 2) au 3 grade de libertate de translație și 2 grade de libertate de rotație:i= irapid + ivr=3 + 2=5.
Grade de libertate translaționale sunt asociate cu mișcarea moleculei ca întreg în spațiu, rotaționale - cu rotația moleculei ca întreg. Rotația față de axele de coordonateXși z la colț va duce la o schimbare a poziției moleculelor în spațiu, atunci când se rotesc în jurul axei la molecula nu își schimbă poziția, deci coordonatele φ ynu este necesar în acest caz. O moleculă triatomică legată rigid are 6 grade de libertate
i= irapid + ivr=3 + 3=6
Dacă legătura dintre atomi nu este rigidă, atunci vibrațională cu căldura libertăţii. Pentru o moleculă neliniarăsi numarul . = 3 N - 6 , Unde Neste numărul de atomi dintr-o moleculă.
Indiferent de numărul total de grade de libertate ale moleculelor, 3 grade de libertate sunt întotdeauna translaționale. Niciunul dintre gradele progresive nu are un avantaj față de celelalte, astfel încât fiecare dintre ele are aceeași energie în medie, egală cu 1/3 din valoare.
![]()
Boltzmann a stabilit legea conform căreia pentru un sistem statistic (adică pentru un sistem cu un număr mare de molecule) în stare de echilibru termodinamic, fiecare grad de libertate translațional și rotațional are o energie cinematică medie egală cu 1/2. kT , iar pentru fiecare grad de libertate vibrațional - în medie, o energie egală cu kT ... Gradul de libertate vibrațional „are” de două ori mai multă energie, deoarece ține cont nu numai de energia cinetică (ca în cazul mișcării de translație și rotație), ci și de energia potențială șiastfel energia medie a moleculei este
Până acum, am folosit conceptul de molecule ca bile elastice foarte mici, a căror energie cinetică medie se presupunea a fi egală cu energia cinetică medie a mișcării de translație (vezi formula 6.7). Acest concept de moleculă este valabil numai pentru gazele monoatomice. În cazul gazelor poliatomice, la energia cinetică contribuie și mișcarea de rotație a moleculelor, iar la temperaturi ridicate, mișcarea de vibrație a moleculelor.
Pentru a estima ce fracție din energia moleculei cade pe fiecare dintre aceste mișcări, introducem conceptul grade de libertate... Numărul de grade de libertate ale unui corp (în acest caz, o moleculă) este înțeles ca numărul de coordonate independente, definind complet poziția corpului în spațiu. Numărul de grade de libertate ale moleculei va fi notat cu litera i.
Dacă molecula este monoatomică (gaze inerte He, Ne, Ar etc.), atunci molecula poate fi considerată ca punct material. Deoarece poziția materialului este determinată de trei coordonate x, y, z (Figura 6.2, a), o moleculă monoatomică are trei grade de libertate de mișcare de translație (i = 3).

O moleculă de gaz biatomic (Н 2, N 2, О 2) poate fi reprezentată ca un set de două puncte materiale legate rigid - atomi (Figura 6.2, b). Pentru a determina poziția unei molecule diatomice, coordonatele liniare x, y, z nu sunt suficiente, deoarece molecula se poate roti în jurul centrului coordonatelor. Evident, o astfel de moleculă are cinci grade de libertate (i = 5): - trei - mișcare de translație și două - rotație în jurul axelor de coordonate (din trei unghiuri 1, 2, 3, doar două sunt independente).
Dacă o moleculă este formată din trei sau mai mulți atomi care nu se află pe o singură linie dreaptă (CO 2, NH 3), atunci ea (Figura 6.2, c) are șase grade de libertate (i = 6): trei - mișcare de translație și trei - rotatie in jurul axelor de coordonate.
S-a arătat mai sus (vezi formula 6.7) că energia cinetică medie  mișcarea de translație a unei molecule de gaz ideal, luată ca materialpunct, este egal cu 3 / 2kТ. Atunci un grad de libertate al mișcării de translație are o energie egală cu 1 / 2kТ. Această concluzie în fizica statistică este generalizată sub forma legii lui Boltzmann privind distribuția uniformă a energiei moleculelor pe gradele de libertate: statistic, în medie, orice grad de libertate al moleculelor are aceeași energie, ε i, egală cu:
mișcarea de translație a unei molecule de gaz ideal, luată ca materialpunct, este egal cu 3 / 2kТ. Atunci un grad de libertate al mișcării de translație are o energie egală cu 1 / 2kТ. Această concluzie în fizica statistică este generalizată sub forma legii lui Boltzmann privind distribuția uniformă a energiei moleculelor pe gradele de libertate: statistic, în medie, orice grad de libertate al moleculelor are aceeași energie, ε i, egală cu:
Astfel, energia cinetică medie totală a moleculei este
 (6.12)
(6.12)
În realitate, moleculele pot efectua și mișcări vibraționale, iar gradul de libertate vibrațional are în medie de două ori mai multă energie decât translația sau rotația, adică. kT. În plus, atunci când luăm în considerare modelul de gaz ideal, noi, prin definiție, nu am luat în considerare energia potențială de interacțiune a moleculelor.
Numărul mediu de ciocniri și calea liberă medie a moleculelor
Este convenabil să se caracterizeze procesul de ciocnire a moleculelor prin valoarea diametrului molecular efectiv d, care este înțeles ca distanța minimă la care centrele a două molecule se pot apropia unul de celălalt.
Se numește distanța medie pe care o parcurge o moleculă între două ciocniri succesive înseamnă cale liberă molecule  .
.
Datorită naturii haotice a mișcării termice, traiectoria unei molecule este o linie întreruptă, ale cărei puncte de rupere corespund punctelor de ciocnire cu alte molecule (Figura 6.3). Într-o secundă, o moleculă parcurge o cale egală cu viteza medie aritmetică  ... Dacă
... Dacă  este numărul mediu de ciocniri pe secundă, apoi calea liberă medie a unei molecule între două ciocniri succesive
este numărul mediu de ciocniri pe secundă, apoi calea liberă medie a unei molecule între două ciocniri succesive
 =
= /
/ (6.13)
(6.13)
Pentru determinare  molecula este reprezentată de o minge cu diametrul d (alte molecule vor fi considerate nemișcate). Lungimea traseului parcurs de moleculă în 1 s va fi egală cu
molecula este reprezentată de o minge cu diametrul d (alte molecule vor fi considerate nemișcate). Lungimea traseului parcurs de moleculă în 1 s va fi egală cu  ... O moleculă pe această cale se va ciocni numai cu acele molecule ale căror centre se află în interiorul unui cilindru spart cu raza d (Figura 6.3). Acestea sunt moleculele A, B, C.
... O moleculă pe această cale se va ciocni numai cu acele molecule ale căror centre se află în interiorul unui cilindru spart cu raza d (Figura 6.3). Acestea sunt moleculele A, B, C.

Numărul mediu de ciocniri în 1 s va fi egal cu numărul de molecule din acest cilindru:
 = n 0 V,
= n 0 V,
unde n 0 este concentrația moleculelor;
V este volumul cilindrului, egal cu:
V = πd 2 
Astfel, numărul mediu de coliziuni
 = n 0 π
= n 0 π  d 2
d 2
Ținând cont de mișcarea altor molecule, mai precis
 =
=
 πd 2 n 0
πd 2 n 0  (6.14)
(6.14)
Atunci calea liberă medie conform (6.13) este egală cu:
 (6.15)
(6.15)
Astfel, calea liberă medie depinde numai de diametrul efectiv al moleculei d și de concentrația lor n 0. De exemplu, să estimăm  și
și  ... Fie d ~ 10 -10 m,
... Fie d ~ 10 -10 m,  ~ 500 m / s, n 0 = 3 10 25 m -3, apoi
~ 500 m / s, n 0 = 3 10 25 m -3, apoi  3 · 10 9 s –1 și
3 · 10 9 s –1 și  7 · 10 - 8 m la o presiune de ~ 10 5 Pa. Cu scăderea presiunii (vezi formula 6.8)
7 · 10 - 8 m la o presiune de ~ 10 5 Pa. Cu scăderea presiunii (vezi formula 6.8)  crește și atinge o valoare de câteva zeci de metri.
crește și atinge o valoare de câteva zeci de metri.
Pentru a înțelege legătura dintre temperatură și energia internă, să repetăm conceptul introdus mai devreme în mecanică - numărul de grade de libertate.
În § 1.3 s-a arătat că presiune gazul este numeric egal cu impuls, care este transferat pe unitatea de timp la o unitate de suprafață a peretelui ca urmare a impactului moleculelor asupra acestuia, prin urmare presiunea este determinată doar de energia medie progresivă mișcarea moleculelor.
Mișcarea de translație a oricărui sistem „ca întreg” este complet determinată de mișcarea unui singur punct: centrul său de masă. În special, impulsul total al oricărui sistem nerelativist este egal cu produsul masei acestui sistem cu viteza de mișcare a centrului său de masă. Energia mișcării de translație a sistemului „ca întreg” este egală cu ![]() ... Prin urmare, pentru descriere completa mișcarea de translație a oricărui sistem în tridimensională spațiu, este necesară și suficientă setarea valorilor Trei coordonatele centrului de masă. Astfel, mișcarea de translație, indiferent de modul în care este structurat sistemul, corespunde întotdeauna la trei grade de libertate de translație:.
... Prin urmare, pentru descriere completa mișcarea de translație a oricărui sistem în tridimensională spațiu, este necesară și suficientă setarea valorilor Trei coordonatele centrului de masă. Astfel, mișcarea de translație, indiferent de modul în care este structurat sistemul, corespunde întotdeauna la trei grade de libertate de translație:.
De asemenea, puteți spune acest lucru: „din punctul de vedere al mișcării de translație” orice sistem poate fi reprezentat exact, și nu aproximativ, sub forma unui singur punct material care coincide cu centrul de masă al sistemului și având o masă egală cu masa sistemului (fig. 1.15).

Orez. 1.15. Moleculă monoatomică
Dacă vorbim despre energia internă totală a gazului U, apoi constă, în general, din multe componente corespunzătoare tuturor tipurilor posibile de mișcare într-o moleculă și din energia de interacțiune a moleculelor între ele. Când se consideră un gaz ideal, energia de interacțiune a moleculelor este neglijată.
Să începem cu un gaz nobil precum heliul. Faptul este că toate gazele nobile sunt monoatomice, dintre care heliul este cel mai ușor și, în consecință, cel mai simplu dispozitiv. Atomul de heliu (adică izotopul principal) este un nucleu încărcat pozitiv de 2 protoni și 2 neutroni și o înveliș de electroni de 2 electroni încărcați negativ. Un total de 6 particule, dacă fiecare dintre ele este considerată un punct material, atunci acesta este de 18 grade de libertate. Dar, nu totul este atât de deprimant de sumbru, mecanica cuantică ajută. Fără a intra în detalii „cuantice”, subliniem că pentru a schimba starea învelișului de electroni a atomului de heliu și anume: pentru a-l transfera din starea fundamentală cu cea mai mică energie posibilă în starea excitată cu energie mare, este necesar minim energie aproximativ 20 eV. Mai precis, de exemplu, la excitarea învelișului de electroni a unui atom de heliu, este posibilă o tranziție care necesită 19,8198 eV. Spectrul energetic al atomilor este discret: este ușor de acceptat o energie mai mică a unui atom de heliu nu poti, asa functioneaza. Când un atom de heliu se ciocnește cu un electron de energie mai mică, atomul de heliu va rămâne în starea inițială - fundamentală cu cea mai mică energie internă posibilă, a cărei valoare depinde doar de alegerea originii numărului de energie și, cel mai mult. adesea, se presupune că este pur și simplu zero. O astfel de coliziune va fi absolut elastică. Rețineți că
Prin urmare, o energie de 20 eV corespunde unei temperaturi de ordinul kelvinului. Probabil că nu este dificil să ne dăm seama că, chiar și la o temperatură de K, atomii de heliu care se mișcă atât de repede încât energia mișcării lor relative este de 100 de ori mai mare decât valoarea medie, vor fi neglijabile. Dar atunci ciocnirile însoțite de o modificare a energiei interne a unuia dintre atomii care se ciocnesc vor fi extrem de rare, prin urmare, posibila prezență a atomilor cu o înveliș de electroni excitați poate fi neglijată și se presupune aproximativ că toți atomii au o înveliș de electroni în aceeași stare de bază cu cea mai mică energie posibilă... Nu este atât de important ca învelișurile de electroni ale tuturor atomilor să aibă cea mai mică energie posibilă, deoarece este important ca la fel toţi atomii şi nu se schimba chiar și cu încălzire puternică pe gaz. Apoi, energia totală a învelișurilor de electroni ale tuturor atomilor este pur și simplu o constantă egală cu, unde N este numărul de atomi din gaz și este energia învelișului de electroni a fiecăruia dintre atomi. Pentru un număr total fix de atomi această valoare nu depinde de niciun parametru al stării gazului... Rămâne să ne amintim încă o dată că energia este întotdeauna determinată cu o precizie până la o constantă aditivă și să renunțăm la această constantă, schimbând originea numărului de energie.
Pentru a schimba starea nucleelor atomice, este necesară o energie de sute de mii de eV, care este monstruos de mare „la scară de gaz”. Temperaturile corespunzătoare sunt observate numai în regiunile interioare ale Stelelor. Prin urmare, despre posibilitatea schimbării stării interne miezuriîn proces de ciocniri în gaz Nu este nevoie să vorbim (adică nuclee stabile, posibila dezintegrare a nucleelor instabile nu are nimic de-a face cu parametrii stării gazului).
Ce a ramas? Rămâne mișcarea de translație a atomului în ansamblu, adică trei grade de libertate de translație. Acest lucru justifică utilizarea unui model ca acesta:
Pentru orice eventualitate, să facem o rezervă că momentan nu ne interesează procesele de stabilire a echilibrului termodinamic în gaz. Echilibrul este stabilit tocmai ca urmare a interacțiunii particulelor de gaz în timpul ciocnirilor lor, prin urmare, modelul „atom - punct material” nu descrie astfel de procese.
Poziția cu învelișul de electroni nu se schimbă dacă atomii fac parte dintr-o moleculă poliatomică. Energia minimă necesară pentru a schimba starea (excitația) învelișului de electroni a moleculelor este aproximativ aceeași ca și pentru excitarea învelișului de electroni a atomilor. Cifra caracteristică pentru lumea atomo-moleculară este de aproximativ 10 eV, ceea ce corespunde unei temperaturi de ordinul a sute de mii de Kelvin. La asemenea temperaturi, gazul nu mai este un gaz, ci o plasmă la temperatură joasă. Prin urmare, în timp ce gazul rămâne un gaz, în majoritatea covârșitoare a cazurilor, se poate presupune cu o precizie excelentă că învelișurile de electroni ale tuturor moleculelor de gaz sunt în aceeași stare, energia lor totală este constantă independentă de parametrii stării gazului care poate fi omis. Desigur, există excepții care necesită o oarecare precauție. De exemplu, o moleculă de oxigen are - după standardele atomo-moleculare - o stare excitată de foarte lungă durată, la care această moleculă are nevoie doar de 0,982 eV. În această stare molecula de oxigen este extrem de activă din punct de vedere chimic, aceasta este o excepție foarte importantă și interesantă în consecințele sale, dar o excepție care trebuie luată în considerare în problemele corespunzătoare, de exemplu, la calcularea vitezelor. reacții chimice implicând această moleculă.
Astfel, în compoziția unei molecule, un atom poate fi privit ca un punct material.
Să ne oprim separat la calcularea numărului de grade de libertate de rotație și vibrație ale moleculelor poliatomice. Să începem prin a considera gradele de libertate de rotație ale unei molecule diatomice. Toate moleculele diatomice sunt liniare din simplul motiv că două puncte nepotrivite definesc o linie dreaptă, cu alte cuvinte, două puncte se află întotdeauna pe o linie dreaptă (Fig. 1.16). Există, de asemenea, molecule mai complexe, dar liniare, de exemplu, o moleculă de dioxid de carbon este liniară: în starea principală (cu cea mai mică energie posibilă), toți cei trei atomi ai săi se află pe o linie dreaptă.

Orez. 1.16. Moleculă diatomică
De obicei, la calcularea energiei interne a unui gaz, se ia în considerare rotația unei molecule liniare doar în jurul celor două axe principale ale sale trecând prin centrul de masă și perpendicular pe axa moleculei, rotația moleculei în jurul axei sale de simetrie nu este luată în considerare, ceea ce este absolut corect. Dar pe această bază, se afirmă că o moleculă liniară are doar 2 grade de rotație de libertate, ceea ce este categoric greșit. Cu toate acestea, în continuare vom scrie într-un asemenea mod care, desigur, necesită o explicație. Faptul că există doar două grade de rotație de libertate este în mod evident greșit din următorul motiv. O moleculă liniară este o formațiune spațială care are dimensiuni finite în toate cele trei dimensiuni. De exemplu, distanța dintre nucleele unei molecule este de metri, iar raza gaz-cinetică (raza în modelul: moleculă - bilă) este egală cu un metru. Razele nucleelor de azot sunt de ordinul unui metru. Având în vedere asta, se ridică o întrebare legitimă: „De ce nu se învârte în jurul propriei axe?” Din nou, mecanica cuantică este de vină. Calculul mecanic-cuantic arată că energia necesară pentru a excita rotația în jurul unei anumite axe este invers proporțională moment de inerție despre această axă. Prin urmare, nu vorbim despre excitația rotației nucleelor - raza acestor „bile” este prea mică, respectiv, energia minimă necesară pentru a le aduce în mișcare de rotație este prea mare. Acesta este din nou sute de keV: așa-numitele niveluri de energie de rotație ale nucleelor. Un singur lucru rămâne: să-și „răscească” învelișul de electroni în jurul axei moleculei, dar orice modificare a stării învelișului de electroni necesită o energie de ordinul a 10 eV. Mai exact, pentru a „răsuci” o moleculă în jurul axei sale, adică pentru a transfera molecula în prima stare excitată rotațional, este nevoie de 7,35 eV, ceea ce corespunde unei temperaturi care depășește șaptezeci de mii de grade. Astfel, la temperaturi „gaz”, adică la acele temperaturi când gazul este încă un gaz, și nu o plasmă (mai puțin de câteva mii de grade), numărul de molecule liniare care se rotesc în jurul propriei axe va fi neglijabil.

Orez. 1.17. Moleculă liniară
Situația generală este următoarea. Aparentă absență o moleculă cu anumite grade de libertate este o consecință a faptului că energia necesară pentru a excita tipurile corespunzătoare de mișcare, din motive cuantice, prea mult Grozav(nu mic!, Fig. 1.17). Moleculele, în care aceste tipuri de mișcare sunt excitate ca urmare a ciocnirilor de molecule între ele, fie nu există deloc (în cantități rezonabile de gaz), fie există, dar într-o cantitate relativă atât de mică încât contribuția de aceste tipuri de mișcare la energia internă a gazului este neglijabilă. Acest lucru se aplică tuturor acelor grade de libertate care sunt asociate cu electronii învelișului de electroni a moleculei. Din acest motiv, atât un atom izolat, cât și un atom dintr-o moleculă pot fi considerați ca punct material (Fig. 1.18).

Orez. 1.18. Moleculă triatomică
Având în vedere cele de mai sus, definiția numărului de grade de libertate ale unei molecule în cadrul modelului: „atom - punct material” se reduce la următoarele.
Dacă o moleculă este formată din atomi - puncte materiale, grade de libertate:
Total- , dintre ei:
progresivă- 3 mereu,
rotativ- 3 (moleculă spațială) sau 2 (moleculă liniară),
vibrational- sau pentru molecule spațiale (liniare).
Vă recomandăm insistent să calculați gradele de libertate exact în această ordine: totul, translațional, rotațional, iar ceea ce rămâne este oscilant. Nu trebuie să ne ghidăm după formulele chimice structurale, ele arată legături chimice, și nu posibilitățile anumitor mișcări vibraționale ale grupurilor de nuclee sau ale nucleelor individuale de atomi care alcătuiesc molecula. De exemplu, posibilitatea vibrațiilor de torsiune nu se reflectă în niciun fel. Utilizarea acestor formule duce cel mai adesea la erori la calcularea numărului de grade de libertate vibraționale. Există un singur lucru de știut despre structura unei molecule: dacă este liniară sau nu.
Să dăm trei exemple de calcul al numărului de grade de libertate pentru molecule ![]() ... Introducem mai întâi un „număr clasic”, pe care îl notăm că va fi necesar în viitor:
... Introducem mai întâi un „număr clasic”, pe care îl notăm că va fi necesar în viitor:
aici numărul de grade de libertate de translație, numărul de grade de libertate de rotație și numărul de grade de libertate vibraționale. Din cauza celor doi din față, acest număr nu este deloc egal cu numărul total de grade de libertate ale moleculei și nu trebuie numit așa.
Tabelul 1.4.1.
|
Molecula / Grade libertate; |
liniar |
liniar |
plat sau spațială |
|
|
Translativ |
||||
|
Rotațional |
||||
|
Oscilatoare |
||||
Molecula de etan are două configurații de echilibru: într-un caz, toți cei opt atomi se află în același plan, într-o altă configurație de echilibru a planului, în care se află cvadrupla „stânga” și cvadrupla „dreapta”, sunt reciproc perpendiculare. În ambele configurații de echilibru, sunt posibile vibrațiile de torsiune ale acestor planuri cu atomi în jurul pozițiilor lor de echilibru. Vibrațiile atomilor, sau mai degrabă nucleele atomilor care alcătuiesc o moleculă poliatomică, sunt mișcarea internă într-o moleculă, de aceea este cel mai convenabil să luăm în considerare această mișcare în sistemul centrului de masă al moleculei.
Pentru a înțelege de ce o moleculă de apă triatomică are trei grade de vibrație de libertate, precum și o moleculă de dioxid de carbon triatomică există patru dintre ele, luați în considerare modurile proprii ale vibrațiilor nucleelor dintr-o moleculă. .
Cele patru moduri de vibrație ale acestei molecule sunt după cum urmează. Modă simetrică: toate cele trei nuclee raman pe o linie dreapta, nucleul de carbon este nemiscat, doi nuclei de oxigen vibreaza in antifaza, adica jumatate din perioada se apropie unul de celalalt si cu nucleul de carbon, deplasandu-se spre acesta din doua laturi opuse; pentru cealaltă jumătate a perioadei, ei, ca și înainte în antifază, se îndepărtează unul de celălalt și de nucleul de carbon. Moda asimetrică: toate cele trei nuclee rămân pe o linie dreaptă, două nuclee de oxigen, în ansamblu (cu distanță constantă între ele), oscilează în antifază cu nucleul de carbon. Modul de deformare dublu degenerat: boabele nu stau pe aceeasi linie dreapta; în momentul în care părăsesc poziţiile de echilibru care se află pe linie dreaptă , ele (toate trei) se deplasează în direcții perpendiculare pe această dreaptă. Dacă, convențional vorbind, axa moleculei este orizontală și nucleul de carbon se mișcă în sus, atunci ambele nuclee de oxigen se deplasează în jos. Adică doi nuclei de oxigen vibrează în fază unul cu celălalt și în antifază cu nucleul de carbon. Acest lucru este de înțeles: altfel centrul de masă al moleculei nu va rămâne nemișcat.
Doi strict egali frecvențele naturale ale modului de deformare dublu degenerat corespund mișcării nucleelor în două planuri reciproc perpendiculare. Dacă vibrațiile doar unuia dintre cele două moduri de deformare sunt excitate, atunci toate cele trei nuclee rămân într-un plan fixat în spațiu. Dacă oscilațiile sunt excitate în ambele planuri reciproc perpendiculare (ambele moduri), atunci traiectorii tuturor celor trei nuclee, ca rezultat al adunării a două oscilații reciproc perpendiculare cu frecvențe strict egale, sunt elipse și cu amplitudini și deplasări de fază egale, există sunt cercuri. În plus, dacă nucleul de carbon se mișcă de-a lungul elipsei sale „în sensul acelor de ceasornic”, atunci ambele nuclee de oxigen se mișcă de-a lungul elipselor lor identice „în sens invers acelor de ceasornic”. Cuvintele „pe” și „împotrivă” sunt puse între ghilimele dintr-un motiv evident: sunt condiționate, deoarece depind de ce parte să priviți.
Astfel, doar trei frecvențe diferite corespund celor patru grade de vibrație de libertate ale moleculei, deoarece modul de deformare este degenerat de două ori.
Orice moleculă diatomică din cadrul modelului „atom - punct material” are un grad de libertate vibrațional, care corespunde unei mișcări foarte simple: distanța dintre cei doi nuclei ai săi oscilează. Cu toate acestea, destul de des, caracteristicile macroscopice ale unui gaz biatomic, de exemplu, capacitatea sa de căldură la volum și presiune constantă, raportul lor - exponentul adiabatic și altele, au (cu o precizie procentuală!) Asemenea valori ca și cum aceste molecule ar fi făcut-o. nu au un grad de libertate vibrațional. Să subliniem că acest „incident” are loc, în primul rând, nu pentru toate moleculele și, în al doilea rând, numai la temperaturi nu prea ridicate, care nu depășesc câteva sute de kelvin. Această situație apare, de exemplu, pentru aer (aproximativ 80% azot și 20% oxigen) la temperatura camerei ![]() ... Este destul de evident că numărul de grade de libertate ale unei molecule nu poate depinde de parametrii stării gazului din care face parte. Acest număr este determinat de tridimensionalitatea spațiului și de modelul: „atom - punct material”. Întrebarea este: „Ce se întâmplă?”
... Este destul de evident că numărul de grade de libertate ale unei molecule nu poate depinde de parametrii stării gazului din care face parte. Acest număr este determinat de tridimensionalitatea spațiului și de modelul: „atom - punct material”. Întrebarea este: „Ce se întâmplă?”
Pentru a excita vibrațiile nucleelor dintr-o moleculă de azot, este necesar să i se imparte energie nu mai mică decât cea a unei molecule de oxigen, așa cum se spune în astfel de cazuri, „cuantumul vibrațional” este puțin mai mic, și anume:. Anticipând calculul mecanic-cuantic în sine, să raportăm rezultatele acestuia.
La temperatura camerei ![]() proporţia moleculelor de azot excitate vibraţional din numărul lor total va fi de aproximativ
proporţia moleculelor de azot excitate vibraţional din numărul lor total va fi de aproximativ 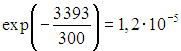 , pentru oxigen această fracție este aproximativ egală cu
, pentru oxigen această fracție este aproximativ egală cu  ... Astfel, în fiecare centimetru cub de aer la temperatura camerei vor exista mai multe molecule de azot excitate vibrațional și de ordinul moleculelor de oxigen excitate vibrațional. În aceste condiții, cu greu se poate spune că aceste molecule sunt „rigide” și au doar cinci grade de libertate, întrucât nu au un grad de libertate vibrațional. Mai mult, chiar și la o temperatură de 1000 K, fracțiile de molecule excitate vibrațional se vor ridica la aproximativ 3% pentru azot și aproximativ 10% pentru oxigen. Ca un alt exemplu, să citam o moleculă în care energia minimă a tuturor este necesară pentru a excita vibrațiile nucleelor. Deja la temperatura camerei, fracția de molecule excitate vibrațional va fi de aproximativ 20%. Vibrațiile nucleelor din această moleculă nu pot fi neglijate deja la temperatura camerei.
... Astfel, în fiecare centimetru cub de aer la temperatura camerei vor exista mai multe molecule de azot excitate vibrațional și de ordinul moleculelor de oxigen excitate vibrațional. În aceste condiții, cu greu se poate spune că aceste molecule sunt „rigide” și au doar cinci grade de libertate, întrucât nu au un grad de libertate vibrațional. Mai mult, chiar și la o temperatură de 1000 K, fracțiile de molecule excitate vibrațional se vor ridica la aproximativ 3% pentru azot și aproximativ 10% pentru oxigen. Ca un alt exemplu, să citam o moleculă în care energia minimă a tuturor este necesară pentru a excita vibrațiile nucleelor. Deja la temperatura camerei, fracția de molecule excitate vibrațional va fi de aproximativ 20%. Vibrațiile nucleelor din această moleculă nu pot fi neglijate deja la temperatura camerei.
Nu este rezonabil să spunem că prezența sau absența unui grad de libertate vibrațional într-o moleculă diatomică depinde de tipul de moleculă și de temperatura gazului. Aceasta este o încercare de a „înghesui” mișcarea vibrațională a nucleelor, care este de natură cuantică, în cadrul unei descrieri clasice (nu cuantice), care este inadecvată în acest caz. O moleculă diatomică are întotdeauna un grad de libertate vibrațional, dar contribuția mișcării vibraționale a nucleelor dintr-o astfel de moleculă la energia internă a gazului, la capacitatea termică și, la exponentul adiabatic și la alte caracteristici ale gazului poate fi neglijabilă dacă inegalitatea
![]()
unde este constanta Boltzmann introdusă mai sus. Când inegalitatea opusă este îndeplinită
mişcarea oscilatorie a nucleelor nu poate fi neglijată în niciun fel. Descrierea clasică (non-cuantică) a mișcării vibraționale a nucleelor din molecule este posibilă numai în cazul unei energii de excitație scăzute a mișcării vibraționale și a unei temperaturi suficient de ridicate și anume: când inegalitatea
![]() ,
,
care în practică se realizează numai în cazuri rare excepţionale ca o moleculă. În aerul pe care îl putem respira relativ confortabil, nu sunt descrise vibrațiile nucleelor din molecule și mecanica clasică.
Să revenim acum la gazul ideal. Am văzut că energia cinetică medie a mișcării de translație a moleculelor este
![]()
iar mișcarea de translație corespunde la trei grade de libertate. Aceasta înseamnă că pentru un grad de libertate, într-o stare de echilibru termodinamic, există o energie medie
În descrierea clasică (nu cuantică), toate tipurile de mișcare sunt egale. Moleculele se ciocnesc și se poate întâmpla cu ușurință ca energia mișcării de translație să fie convertită în energie a mișcării de rotație. Prin urmare, în medie, aceeași cantitate de energie ar trebui să cadă pe fiecare dintre gradele de libertate de rotație -
Această afirmație este cunoscută ca Legea lui Boltzmann privind echipartiția energiei asupra gradelor de libertate.Într-un mod similar, ciocnirile de molecule pot da naștere la mișcări vibraționale ale nucleelor în ele, astfel încât legea clasică a echipartiției se aplică și gradelor de libertate vibraționale ale moleculelor. Dar există o subtilitate aici. Dacă numai energia cinetică corespunde mișcărilor de translație și rotație, atunci un oscilator armonic (un grad de vibrație de libertate) are, în medie, energii cinetice și potențiale strict egale. Prin urmare, în medie, într-o stare de echilibru termodinamic, în condiţiile de aplicabilitate a descrierii clasice a mişcării oscilatorii, pentru un grad de libertate vibrațional, există de două ori mai multă energie decât nu mai este numărul nominal de grade vibraționale ale unei molecule poliatomice, atunci energia medie a unei molecule va fi egală cu
ne vom familiariza în capitolul următor, unde va fi clarificat sensul acestui termen. După cum se arată mai sus, mișcarea vibrațională a nucleelor din molecule este excitată numai după atingerea temperaturilor suficient de ridicate ( T> 1000 K), prin urmare, contribuția lor la energia internă a gazului pentru majoritatea moleculelor la temperaturi obișnuite (aproape de camera) este neglijabilă, nu o vom lua în considerare, adică dacă nu se specifică altfel vom presupune că
![]() ,
,
unde și sunt egale cu numărul nominal de grade de libertate de translație (întotdeauna 3) și, respectiv, de rotație (3 sau 2), structura moleculei.
Exemplu.Într-un volum de cameră 75 m 3 există un gaz biatomic (aer) la o temperatură t = 12 ° С (T = 285 K). Porniți încălzitorul și ridicați temperatura aerului la t 2 = 22 ° С (T2 = 295 K). Deoarece camera nu este presurizată, presiunea gazului rămâne constantă și egală în orice moment 100 kPa... Să aflăm modificarea energiei interne a gazului din cameră și să stabilim ce energie a fost cheltuită pentru încălzirea mediului.
Răspunsul este oarecum neașteptat: conform (1.19), energia internă a gazului din cameră nu s-a schimbat, deoarece atât presiunea, cât și volumul acestuia au rămas aceleași. Pe de altă parte, o parte din gaz a părăsit încăperea: dacă la început a conținut
Deoarece energia internă este proporțională cu temperatura absolută, după încălzirea camerei etanșe, se dovedește că

adică se primește energie de la sobă
În al doilea pas, scoatem din cameră 3,39 % aer încălzit și, odată cu acesta, aceeași cotă de energie. Energie detașabilă
exact egal cu energia primită de la sobă. Într-un mod diferit, am ajuns din nou la aceeași concluzie.
Așadar, acum este în sfârșit clar că aerul care ieșea în stradă a luat cu el toată energia primită de la sobă. Care este, deci, rolul aragazului? A meritat să-l pornești deloc dacă doar încălzește strada? Efectul util al aragazului este că, la o temperatură de 12 grade, pierderea de căldură a unei persoane în aerul din jur este atât de mare (în ciuda faptului că este îmbrăcată, probabil) încât sistemul de termoreglare al corpului poate face față dificultăților de a menține o stare normală. temperatura si semnaleaza asta: persoana rece, inconfortabila! Și la o temperatură de 22 de grade, pierderea de căldură este semnificativ mai mică, sarcina asupra sistemului de termoreglare este mai mică - o persoană se simte destul de confortabil și nu are dorința de a porni încălzitorul.
Informații suplimentare
http://eqworld.ipmnet.ru/ru/library/physics/thermodynamics.htm - J. de Boer Introducere în fizica moleculară și termodinamică, Ed. IL, 1962 - pp. 50–61, partea I, § 6, - sunt date calculul teoretic al capacităților termice, dependențele experimentale ale capacității termice la volum constant într-un domeniu larg de temperatură pentru zece gaze specifice.
Ne întoarcem acum la o analiză detaliată a conceptului de energie internă a unui gaz ideal și a relației dintre această energie cu numărul de grade de libertate al moleculelor. Anterior, în modelul gazului ideal, am luat în considerare doar energia mișcării de translație a moleculelor. Această abordare descrie un puț de gaz monoatomic. Conform mecanicii clasice, numărul grade de libertate ale unei molecule monoatomice este egal cu numărul de coordonate necesare pentru a-și stabili poziția în spațiu. În spațiul nostru tridimensional, numărul de coordonate și numărul de grade de libertate ale unui gaz monoatomic este egal cu trei. În conformitate cu (9.6), energia cinetică medie a mișcării de translație a moleculelor, determinată prin pătratul mediu al vitezei v? B, proporțional cu temperatura gazului
În plus, datorită izotropiei spațiului (egalitatea tuturor direcțiilor), pătratele medii ale componentelor vitezei sunt v * KB = Vy KB == Vz KB, ceea ce face posibilă compararea fiecărei coordonate şi a fiecărui grad de libertate cu o treime din energia cinetică medie a mişcării de translaţie a moleculelor. Astfel, putem presupune că pentru fiecare grad de libertate există, în medie, o energie
Dacă molecula de gaz nu este monoatomică, ci este formată din N atomi, atunci pentru a-și stabili poziția în spațiu este necesar 3N coordonate. Astfel, o moleculă din N atomi are 3N grade de libertate. Deoarece o moleculă poliatomică este un singur întreg, este convenabil să se ia în considerare mișcarea centrului său de masă cu trei grade de libertate de translație. În acest caz, gradele de libertate rămase cad pe mișcarea de rotație și vibrație a moleculei. Mecanica teoretică afirmă că o moleculă neliniară constând din trei sau mai mulți atomi este capabilă să participe la trei mișcări de rotație independente în jurul a trei axe de coordonate. Orice altă rotație poate fi gândită ca o combinație a ambelor. Prin urmare, numărul de grade de libertate de rotație ale unei molecule neliniare este de trei. Pentru o moleculă liniară de doi sau mai mulți atomi (aranjați de-a lungul unei linii), luând în considerare rotația în jurul axei care leagă atomii, care sunt considerați puncte materiale, nu contribuie la energie. Prin urmare, numărul de grade de libertate de rotație ale unei molecule liniare este egal cu două. Gradele de libertate rămase sunt pentru mișcarea oscilativă. Este ușor de calculat că numărul de grade de libertate vibraționale pentru o moleculă neliniară este 3N-6,și pentru o moleculă liniară - 3N-5.
În cazul unui gaz poliatomic (precum și pentru unul monoatomic), legea repartizării uniforme a energiei pe gradele de libertate: energia cinetică medie la echilibru termic pe gradul de libertate a moleculei este de ~ kT.
O atenție specială ar trebui acordată energiei gradelor de libertate vibraționale. La temperaturi normale și scăzute, mișcarea vibrațională a moleculelor este de obicei descrisă de legile mecanicii cuantice. Aceste legi fundamentează rigiditatea moleculelor și absența energiei vibraționale - în acest caz, se crede că gradele de libertate vibraționale înghețat afară(absent). La temperaturi ridicate, gradul de libertate vibrațional, în plus față de energia cinetică - kT există aceeași energie potențială, deci suma este kT.(Din modelul oscilatorului armonic rezultă că energia potențială medie a mișcării vibraționale este egală cu energia cinetică medie.)
Astfel, în cazul general, energia internă medie a unei molecule este
iar energia internă a unui mol dintr-un gaz ideal este
Unde i este numărul efectiv de grade de libertate ale moleculei.
După cum rezultă din raționamentul de mai sus, pentru o moleculă monoatomică / = 3, pentru o moleculă liniară la temperaturi normale și scăzute / = 5, pentru o moleculă neliniară la temperaturi normale și scăzute / = 6. La temperaturi ridicate de ordinul a 10 3 K pentru o moleculă liniară i = 6N-5, pentru o moleculă neliniară i =6 N-6 .
Rețineți că la temperaturi foarte scăzute (de ordinul a 10 K), gradele de libertate de rotație îngheață și ele. Acest lucru se datorează faptului că legile mecanicii statistice clasice, pe care se bazează legea distribuției uniforme a energiei pe gradele de libertate, încetează să funcționeze, iar aplicarea legilor mecanicii cuantice este necesară.
Moleculele de gaz ideale nu interacționează între ele și, prin urmare, nu au energie potențială. Prin urmare, toată energia moleculelor unui gaz ideal constă numai din energia cinetică a mișcărilor de translație și rotație. Am determinat energia cinetică medie a mișcării de translație a moleculei în paragraful anterior [formula (17)]. Pentru a lua în considerare energia cinetică medie a mișcării de rotație a unei molecule, este necesar să se introducă în considerare conceptul de număr de grade de libertate ale unui corp.
Numărul de grade de libertate ale unui corp este numărul de coordonate independente care determină poziția corpurilor în spațiu.
Să explicăm această definiție... Dacă corpul se mișcă în spațiu complet arbitrar, atunci această mișcare poate fi întotdeauna compusă din șase mișcări independente simultane: trei de translație (de-a lungul a trei axe ale unui sistem de coordonate dreptunghiular) și trei de rotație (în jurul a trei axe reciproc perpendiculare care trec prin centrul de greutate al corpului). ) (Fig. 75). Cu alte cuvinte, poziția corpului în spațiu este determinată în acest caz de șase coordonate independente: trei liniare și trei unghiulare. În consecință, conform definiției, numărul de grade de libertate ale unui corp care se mișcă în mod arbitrar în spațiu este de șase ( trei grade de libertate de translaţie şi trei de rotaţie). Dacă libertatea de mișcare a corpului este limitată, atunci numărul său de grade de libertate este mai mic de șase. De exemplu, corpul se mișcă doar de-a lungul unui plan, având în același timp posibilitatea de rotație arbitrară (bilul rulant). Atunci numărul gradelor sale de libertate este egal cu cinci (două de translație și trei de rotație). Vagonul de cale ferată are un grad de libertate (translațional), deoarece se deplasează doar de-a lungul liniei. Roata căruciorului are două grade de libertate: unul de translație (împreună cu grinda) și unul de rotație (în jurul axei orizontale).
Să revenim acum la problema energiei cinetice a unei molecule de gaz. Datorită caracterului aleatoriu complet al mișcării moleculelor, toate tipurile de mișcări ale acestora (atât de translație, cât și de rotație) sunt la fel de posibile (la fel de probabile). Prin urmare, pentru fiecare grad de libertate al unei molecule, în medie, există aceeași cantitate de energie (teorema lui Boltzmann privind distribuția uniformă a energiei pe grade de libertate).
Deoarece moleculele se mișcă complet aleatoriu, ar trebui să aibă șase grade de libertate fiecare. Cu toate acestea, aici trebuie luată în considerare următoarea circumstanță.
O moleculă a unui gaz monoatomic (de exemplu, He) poate fi reprezentată ca un punct material, a cărui rotație în jurul propriilor axe nu își schimbă poziția în spațiu. Aceasta înseamnă că pentru a determina poziția unei molecule monoatomice, este suficient să specificați doar coordonatele liniare ale acesteia. Prin urmare, unei molecule monoatomice ar trebui să i se atribuie un număr de grade de libertate egal cu trei (translațional). Din punct de vedere fizic, această împrejurare poate fi explicată astfel. Energia cinetică a mișcării de rotație a corpului (vezi § 23) este egală cu
![]()
unde este viteza unghiulară de rotație, I este momentul de inerție al corpului. Pentru un punct material
unde este masa unui punct material, distanța acestuia față de axa de rotație. Dacă un punct material se rotește în jurul axei sale, atunci Dar atunci și în consecință, o moleculă monoatomică are o energie infinit de mică în mișcarea de rotație (grade de libertate de rotație), care poate fi neglijată. O dovadă riguroasă a acestei poziții este posibilă doar pe baza mecanicii cuantice.

O moleculă a unui gaz diatomic (de exemplu,) poate fi reprezentată ca un set de două puncte materiale - atomi legați rigid unul cu celălalt legături chimice(Fig. 76, a). Rotația unei astfel de molecule în jurul unei axe care trece prin ambii atomi nu schimbă poziția moleculei în spațiu. Din punct de vedere fizic, energia implicată în rotația moleculei în jurul axei care trece prin atomi este aproape de zero. De aceea moleculă diatomică ar trebui să fie atribuite cinci grade de libertate (trei de translație și două de rotație).
În ceea ce privește o moleculă triatomică (Fig. 76, b), ea are în mod evident toate cele șase grade de libertate (trei de translație și trei de rotație). Alte molecule poliatomice (tetraatomice, cinciatomice etc.) au același număr de grade de libertate.
Pentru a calcula energia cinetică medie pe un grad de libertate al moleculei, folosim formula (17):
Deoarece această energie se obține pentru o moleculă monoatomică (ca punct material), care are trei grade de libertate, atunci un grad de libertate al moleculei are energie
![]()
Apoi, conform teoremei Boltzmann menționate, o moleculă cu grade de libertate va avea energie cinetică totală
![]()
În consecință, energia cinetică totală a unei molecule de gaz este proporțională cu temperatura sa absolută și depinde numai de aceasta.
Din formula (19) rezultă semnificația fizică a zeroului absolut al temperaturii: la voință, adică la zero absolut, mișcarea moleculelor de gaz se oprește.
Conform formulei (19), o moleculă monoatomică are o energie totală
![]()
o moleculă diatomică are energie totală
![]()
moleculele triatomice și poliatomice au energie totală
![]()
Atunci energia internă a unei anumite mase de gaz este egală cu produsul dintre numărul de molecule conținute în această masă cu energia cinetică totală a unei molecule:
![]()
Deoarece pentru un mol de gaz, atunci pentru energia internă a unei mol obținem (ținând cont de faptul că






